Auf was es wirklich bei der Therapie ankommt
Die Naturheilkunde wusste schon vor über 100 Jahren, dass das Immunsystem der Schlüssel zur nachhaltigen Krebstherapie ist. Doch es stellte sich heraus, dass eine ungezielte Immunstärkung nicht zum erhofften Ziel führte. Das Immunsystem hatte den Krebs einfach nicht erkannt. Es zeigte sich, dass man es nicht stärken, sondern vielmehr die „Bremsen“ entfernen muss. Denn die Krebszellen blockieren die T-Zellen und bremsen daher das Immunsystem raffiniert und unermüdlich aus. Diese „Bremsen“ lösen nun die neuen Immuncheckpoint-Inhibitoren wie Pembrolizumab (Handelsname Keytruda®).
Die Ergebnisse gleichen einem Wunder: Früher galt ein metastasiertes, malignes Melanom als Todesurteil, heute können bei korrekter Behandlung durch eine Kombinationstherapie 60 % der Patienten geheilt werden – so der Nobelpreisträger (2018) Prof. James P. Allison im Interview mit Ralf Moss, einem Urgestein der komplementären Krebstherapie:
| Was sind Checkpoints? Checkpoints sind Rezeptoren, die als Kontrollpunkte auf der Membran von T-Lymphozyten das Immunsystem regulieren. Im Normalfall sorgen sie für ein ausgewogenes Immunsystem: Krankheitserreger werden zerstört, körpereigenes Gewebe nicht. Zu den Rezeptoren gehören passende Liganden, die von anderen Zellen präsentiert oder freigesetzt werden. Krebszellen machen sich dieses System zu Nutze, um dem Immunsystem zu entkommen. Sie sondern vermehrt Proteine ab, welche genau auf einen Checkpoint-Rezeptor passen, was zur Folge hat, dass die T-Lymphozyten die Krebszellen tolerieren. Somit gelingt es Ihnen, der Zerstörung durch die T-Zellen zu entfliehen. Die Unterdrückung der T-Zellen durch die Krebszelle bezeichnet man auch als „Bremsen“ des Immunsystems. Wie funktionieren Immuncheckpoint-Inhibitoren? |
Wann funktioniert die Immuntherapie und wann nicht?
In der Praxis ist es so, dass die Immuntherapie oft nicht funktioniert. Sie scheitert an fehlendem Wissen und noch mehr an den Krankenkassen, die sie nur als Ultima Ratio erlauben – also dann, wenn es zu spät ist. Das spart den Kassen hohe Beträge und kostet viele Patienten das Leben. Gerade hier ist die Synthese von naturheilkundlichem Wissen und modernster Onkologie ausschlaggebend.
Denn entscheidend für das Funktionieren der Immuntherapie ist:
- Lymphozyten sind noch ausreichend vorhanden und nicht von Chemotherapien ausradiert.
- Die Lymphozyten müssen „trainiert“ sein, was durch eine gesunde Darmflora geschieht.
- Die Lymphozyten erkennen die Krebszellen tatsächlich, wofür sie Antigene von abgetöteten Krebszellen benötigen.
Aufgrund des letzten Aspektes kann eine Kombination der Immuntherapie mit dem dosierten Einsatz einer Chemo- oder noch besser einer Bestrahlungstherapie hilfreich sein. Die Immuntherapie sollte in diesen Fällen früh erfolgen und eben nicht wie üblich in einem späten Stadium, nachdem zahlreiche Chemotherapie-Zyklen das Immunsystem bereits zerstört haben. Der Lymphozyten-Rückgang nach einer Chemotherapie ist Onkologen eigentlich seit Jahrzehnten bekannt. Nach Abschluss einer Chemotherapie kann es zwischen 21 und 28 Tagen dauern, bis sich das Immunsystem erholt hat. Studien aus der Brustkrebsforschung zeigen, dass durch eine Chemotherapie alle Lymphozyten-Arten (B-Zellen, T-Zellen und NK-Zellen) signifikant reduziert werden. Die B-Lymphozyten zeigen einen besonders dramatischen Rückgang (Verma et al., 2016).
Beachtet man dies, kann die Immuntherapie auch bei vielen anderen Krebsarten greifen, z. B. bei einem aggressiven Lungen- oder Cervix-Karzinom. Doch wie sieht die übliche Vorgehensweise in Deutschland aus? Diverse Chemotherapien und Bestrahlung, ein daraufhin zerstörtes Immunsystem, gefolgt von Infektionen und daraufhin eine Antibiose. Erst danach wird die Immuntherapie von Ärzten überhaupt in Betracht gezogen. Bei dieser Vorgehensweise ist nach aktueller Studienlage fast sichergestellt, dass eine Immuntherapie unwirksam ist.
Das „Vorhersagesystem“ der University of Texas
Die University of Texas hat ein prognostisches Bewertungssystem eingeführt, das bei der Auswahl von Patienten helfen kann, die auf eine Behandlung mit einem Immuncheckpoint-Inhibitor ansprechen oder eben auch nicht – mittendrin und involviert auch Prof. Allison (Sen et al., 2018). Das Bewertungssystem basiert auf einer Analyse von 172 Patienten mit metastasierendem Krebs. Als der größte Risikofaktor für das Nichtansprechen auf die Therapie und damit auch ein kürzeres Überleben erwies sich entsprechend der Wirkungsweise der Immuncheckpoint-Inhibitoren eine absolute Lymphozytenzahl unter 1.800 Zellen pro µL Blut. Der Normbereich der Lymphozyten bei einem Erwachsenen liegt zwischen 1.000 und 4.800 Zellen pro µL Blut.
Die University of Texas hat zudem sechs weitere Risikofaktoren identifiziert, die ein Ansprechen auf die Immuntherapie unwahrscheinlicher machen. Die Faktoren spiegeln u. a. eine Entzündung (erhöhte Zahl von Neutrophilen und Thrombozyten) und vermehrt zerstörte Zellen (erhöhtes LDH) im Körper wieder. In nachfolgender Aufzählung sind sie mit einer Hazard-Ratio (HR) angegeben. Die Hazard-Ratio gibt die Wahrscheinlichkeit für das Auftreten eines bestimmten Ereignisses wieder und drückt in der Studie aus, um welchen Faktor die Sterblichkeit erhöht wurde.
- Geringe absolute Lymphozytenzahl unter 1.800 Zellen pro µL Blut [HR = 3,3]
- Einschränkung bei körperlicher Arbeit (WHO Performance-Status größer als 1) [HR = 2,81]
- Erhöhte Neutrophilenzahl von mehr als 4.900 Zellen pro µL Blut [HR = 2,3]
- Erhöhter Serum-Laktat-Dehydrogenase-Wert (LDH) von mehr als 466 Enzymeinheiten pro L Blutserum [HR = 2,1]
- Das Vorhandensein von Lebermetastasen [HR = 1,8]
- Erhöhte Thrombozytenzahl von mehr als 300.000 Zellen pro µL EDTA-Blut [HR = 1,8]
- Alter von über 52 Jahren [HR = 1,59]
Bei einer Lymphozytenzahl unter 1.800 Zellen pro µL Blut war die Sterblichkeit also 3,3-mal so hoch wie bei einer höheren Lymphozytenzahl. Auch die reine Anzahl der Risikofaktoren ist für die Vorhersage für das Überleben bereits sehr aussagekräftig: Patienten mit 0-2 Risikofaktoren überlebten im Mittel 24 Monate, während Patienten mit 3, 4 bzw. mehr Risikofaktoren nur 12, 8 bzw. 4 Monate überlebten.
Fataler Einfluss von Antibiotika auf die Immuntherapie
In der Naturheilkunde ist die immense Bedeutung der Darmflora für das Immunsystem seit langem bekannt. Bei der Immuntherapie entscheidet die Darmflora quasi über Leben und Tod. Dies zeigt eindrucksvoll eine multizentrische Kohortenanalyse aus Großbritannien. Eine vorangegangene Antibiose hatte einen massiven Einfluss auf die Behandlungsergebnisse der Immuntherapie bei Patienten mit Krebs.
In der prospektiven Längsschnittstudie wurden zwischen Januar 2015 und April 2018 196 Krebspatienten mit überwiegend metastasierter Erkrankung, die mit Checkpoint-Inhibitoren behandelt wurden, untersucht (Pinato et al., 2019). Von den 196 Krebspatienten waren 119 an einem nichtkleinzelligen Lungenkarzinom, 38 an einem Melanom und 39 an anderen Krebsarten erkrankt.
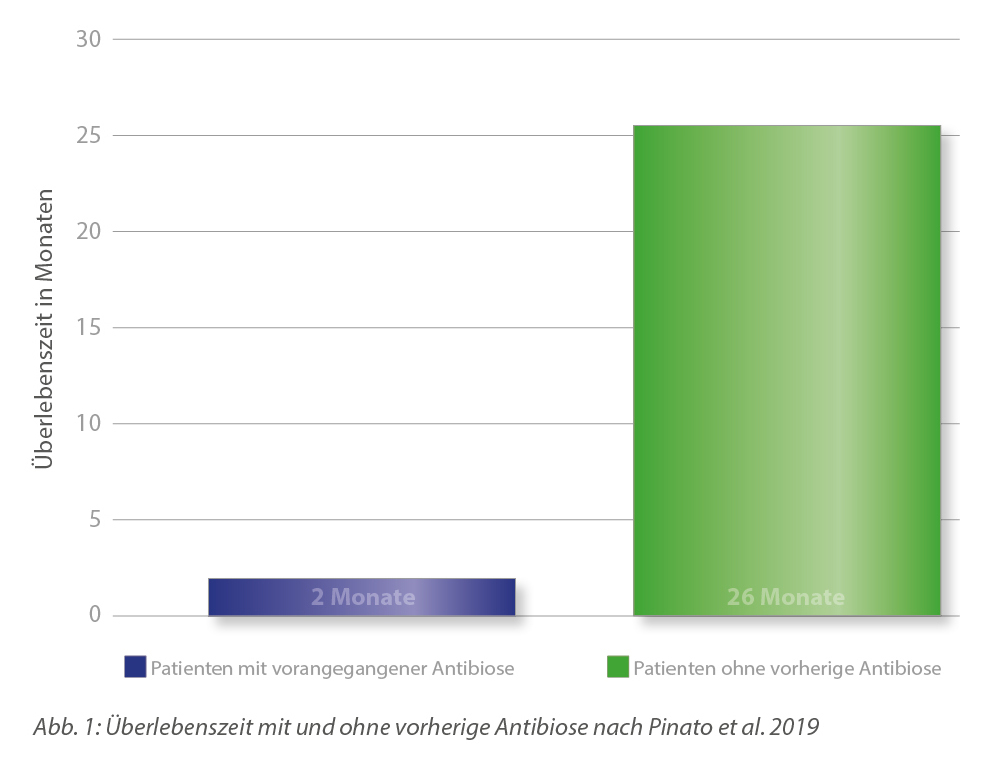
Zur Behandlung von Atemwegsinfektionen erhielten 29 Patienten bis zu 30 Tage vor Beginn der Therapie ein Antibiotikum, 68 Patienten erst parallel zu der Checkpoint-Inhibitor-Therapie. Weder die Wahl des Antibiotikums (meist Betalactam), noch das Krankheitsstadium sowie der anfängliche Zustand der Patienten hatten einen Einfluss auf die Überlebenszeit. Dagegen zeigte sich bei den Patienten mit vorangegangener Antibiotika-Gabe eine deutlich verkürzte Lebenszeit. Sie überlebten nur 2 Monate gegenüber 26 Monaten bei Patienten ohne vorheriger Antibiotika-Therapie (s. Abb. 1). Dieser deutliche Unterschied wurde für alle Tumorentitäten festgestellt. Außerdem sprachen deutlich weniger Patienten mit vorheriger Antibiotika-Therapie auf die Checkpoint-Inhibitoren an (44 % gegenüber 81 %).
Die durch Antibiotika bedingte Veränderung des Mikrobioms und eine damit einhergehende Schwächung des Immunsystems dürften die Ursache für das verringerte Ansprechen auf die Immuntherapien sein – so auch die Vermutung der Autoren.
Ein hochaktuelles, systemisches Review bestätigt die Ergebnisse eindrucksvoll (Pierrard & Seront, 2019). Es umfasst 7 Studien, die den Einfluss von Antibiotika auf die Therapie mit Checkpoint-Inhibitoren untersuchten. Die Daten belegen zweifelsfrei, dass der Einsatz von Antibiotika die Wirksamkeit verringern und die Ergebnisse beeinflussen kann – unabhängig von der Krebsart.
Kann das Mikrobiom so verändert werden, dass Immuntherapien besser wirken?
Die Bedeutung des Mikrobioms für Immuntherapien wird ferner in Studien deutlich, die das Stuhlmikrobiom bei Patienten prospektiv zu der Therapie mit Checkpoint-Inhibitoren untersuchten. Responder auf die PD-1-Inhibitor-Therapie (PD-1 ist ein wichtiger Checkpoint) wiesen im Vergleich zu Non-Respondern eine signifikant höhere Diversität des Darmmikrobioms auf (Gong et al., 2019).
Daraus ergibt sich die Frage, ob und wie das Mikrobiom so verändert werden kann, dass Immuntherapien mit Checkpoint-Inhibitoren besser funktionieren. Erste Studien, die den Einfluss einer Probiotika-Gabe im Vorfeld einer Therapie untersuchen, laufen. Doch die klassischen Probiotika können die große Vielfalt einer gesunden Darmflora nicht ersetzen. Dafür scheint der Transfer von Darmbakterien eine mögliche Lösung zu sein. Stuhltransplantationen verbesserten in Studien das Ansprechen bei Non-Respondern. Zudem ist die Stuhltransplantation ein vielversprechendes Konzept zur Verringerung der Immuntherapie-assoziierten Colitis (Pierrard & Seront, 2019).
Fazit
Immuncheckpoint-Inhibitoren lösen die „Bremsen“ des Immunsystems, die auf der Membran der Lymphozyten sitzen. Die Immuntherapie mit Immuncheckpoint-Inhibitoren steht und fällt daher mit der Anzahl und dem Trainingszustand der Lymphozyten des Patienten. Als sicher gilt, dass das richtige Darmbakterien-Futter für das Immunsystem sehr wichtig ist: Eine pflanzen- und ballaststoffreiche Ernährung leistet einen wichtigen Beitrag zur gesunden Vielfalt des Mikrobioms und ist daher unabhängig von allen medikamentösen Behandlungen mehr als sinnvoll.
Ausschlaggebend sind zudem die Faktoren, die das (Darm-assoziierte) Immunsystem angreifen: Chemo- und Bestrahlungs-Therapien und die Gabe von Antibiotika. Sie müssen wohldosiert und mit Bedacht eingesetzt werden, will man die Behandlung mit Immuncheckpoint-Inhibitoren nicht negativ beeinflussen. Vorausgesetzt die Immuntherapie wird frühzeitig bei intaktem Immunsystem angewandt, kann eine intelligent eingesetzte Chemo- oder Strahlentherapie sehr sinnvoll sein: Denn die zerstörten Krebszellen präsentieren Antigene und verbessern so die Wirkung der Immuntherapie, weil die Lymphozyten die Krebszellen nun optimal identifizieren können.
Mit diesen wissenschaftlichen Erkenntnissen ist es fatal, die Immuntherapie weiterhin nur als Ultima Ratio anzuwenden.
Literatur:
- Gong J, Chehrazi-Raffle A, Placencio-Hickok V, Guan M, Hendifar A, Salgia R. The gut microbiome and response to immune checkpoint inhibitors: preclinical and clinical strategies. Clin Transl Med 2019; 8(1):9
- Pierrard J, Seront E. Impact of the gut microbiome on immune checkpoint inhibitor efficacy – a systematic review. Curr Oncol. 2019;26(6):395-403. doi:10.3747/co.26.5177
- Pinato DJ, Howlett S, Ottaviani D et al. Association of Prior Antibiotic Treatment With Survival and Response to Immune Checkpoint Inhibitor Therapy in Patients With Cancer. JAMA Oncol 2019; 5(12):1774–1778
- Sen S, Hess K, Hong DS et al. Development of a prognostic scoring system for patients with advanced cancer enrolled in immune checkpoint inhibitor phase 1 clinical trials. Br J Cancer 2018; 118(6):763–769
- Verma, R., Foster, R.E., Horgan, K. et al. Lymphocyte depletion and repopulation after chemotherapy for primary breast cancer. Breast Cancer Res 18, 10 (2016). https://doi.org/10.1186/s13058-015-0669-x



Eine Antwort
Finde ich sehr interessant! Danke!